细胞迁移与侵袭实验将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上下层培养液以聚碳酸酯膜相隔,将研究的细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。
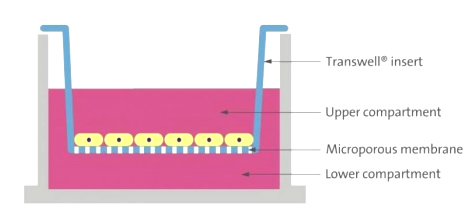
一、Transwell检测原理
将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上下层培养液以聚碳酸酯膜相隔。我们将细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。Transwell迁移实验常用8.0、12.0 µm膜,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
二、检测方法:
(1)所有细胞培养试剂和Transwell chamber 放在37℃温育;
(2)待测细胞培养至对数生长期,消化细胞,用PBS和无血清培养基先后洗涤一次,用无血清培养基悬浮细胞,计数,调整浓度为2×105 /ml;
(3)在下室(即24孔板底部)加入600-800μl 含10%血清的培养基,上室加入100-150μl细胞悬液,继续在孵箱培养24小时;
(4)用镊子小心取出chamber,吸干上室液体,移到预先加入约800μl甲醇的孔中,室温固定30分钟;
(5)取出chamber,吸干上室固定液,移到预先加入约800μl Giemsa染液的孔中,室温染色15-30分钟; (6)轻轻用清水冲洗浸泡数次,取出chamber,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞; (7)用小镊子小心揭下膜,底面朝上晾干,移至载玻片上用中性树胶封片;
(8)显微镜下取9个随机视野计数,统计结果。
注意事项
(1)根据待测细胞体积大小选择合适孔径的chamber。常用的为8.0-μm孔径(如AGS细胞),如果细胞体积较大可以考虑用10-μm孔径;
(2)根据待测细胞的迁移能力强弱调整细胞数和迁移时间。常规24-well chamber接种细胞数约为2≈5×104/well,迁移时间12≈36小时;
(3)由于Corning公司的24-Transwell内含12个独立的chamber,为了避免操作污染,每次实验可预先另准备一块24孔普通培养板(Corning);
(4)如果细胞迁移能力较弱,下室液体可用3T3细胞无血清培养24小时获得的上清加50μg/ml FN(Fibronectin),具体可查阅相关文献;
(5)细胞悬液加入膜中央,尽量保证液面水平;
(6)固定染色擦洗时动作小心,避免擦去膜底面的细胞。但一定要充分擦净膜表面上未迁移的细胞,以免影响读数。尤其是膜周边上可用细牙签或小镊子缠上湿棉花擦洗,但要小心避免将膜戳破;
(7)Chamber和膜上都无法标记,操作时应小心避免混淆实验组和对照组;
(8)充分晾干,避免残留水分导致镜下聚焦不一致。
细胞侵袭实验 (cell invasion assay)
实验材料:
(1)Matrigel (BD 5mg/ml),-20℃保存
(2)其余材料同迁移实验
操作步骤
(1)Matrigel在4℃过夜融化;
(2)用4℃预冷的无血清培养基稀释Matrigel至终浓度1mg/ml,冰上操作;
(3)在chamber上室底部中央垂直加入100μl稀释后的Matrigel,37℃温育4-5小时使其干成胶状;
(4)后续步骤同迁移实验(1-8)。
注意事项
(1)Matrigel在过高或过低的温度均易凝固,因此操作所需枪头和离心管应提前在4℃预冷;
(2)铺胶时保证液面水平,胶的厚度均匀一致,切勿产生气泡;
(3)其他注意事项同迁移试验。
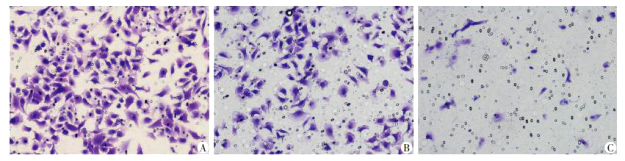
三、结果展示
四、客户提供材料
1、新鲜或正确保存的样品(按照我们的要求提供)
2、阳性对照样品(尽量提供)
3、相关文献(可选)
五、提交给客户结果
1、客户提供的实验样本
2、实验原始数据
3、完整实验报告
六、服务项目说明
1、双方签订合同后,收取70%预付后启动预实验
2、有特殊要求请咨询:400-800-8458